John William Strutt, pierworodny syn barona Rayleigha i dziedzic tytułu, był słabego zdrowia. Nie chodził z tego powodu regularnie do żadnej szkoły, uczył się prywatnie, co chyba mu wyszło na dobre. Studiował w Trinity College w Cambridge i tam w ciągu kilku lat okazało się, że ma talent do matematyki. Z czasem został jednym z najwszechstronniejszych fizyków swoich czasów. Zajmował się wieloma dziedzinami, szczególnie upodobał sobie zjawiska związane z falami różnego rodzaju. Prowadził też eksperymenty, jego największym osiągnięciem było odkrycie argonu, za które uzyskał Nagrodę Nobla w roku 1904, rok po małżonkach Curie. Skromnie opisuje to odkrycie jako rezultat dokładności swoich eksperymentów: azot uzyskany z powietrza i azot uzyskany drogą chemiczną różniły się nieco gęstością. Rayleigh zaczął badać wszystkie możliwe powody tej różnicy i odkrył nowy składnik powietrza, którego istnienia nikt nie podejrzewał.
Prace Rayleigha są znakomicie i przejrzyście napisane, w zbiorowym wydaniu zajmują sześć tomów z pewnością nie dlatego, by autor mnożył je ponad potrzebę, jak to często zdarza się dzisiaj. Zajmiemy się tu tylko jednym tematem badanym przez Rayleigha: rozpraszaniem światła w atmosferze. Bezchmurne niebo jest głęboko błękitne, mimo że powietrze jest przecież oświetlone białym światłem słonecznym. Z punktu widzenia fizyka oznacza to, że światło niebieskie łatwiej jest rozpraszane niż inne barwy. Z tego samego powodu zachodzące słońce jest czerwone: bo światło przechodzi wówczas przez grubszą warstwę atmosfery i światło niebieskie zostało rozproszone na boki – dociera do nas czerwone. Całe piękno wschodów i zachodów słońca sprowadza się więc do zrozumienia, czemu jedne barwy są łatwiej rozpraszane niż inne.

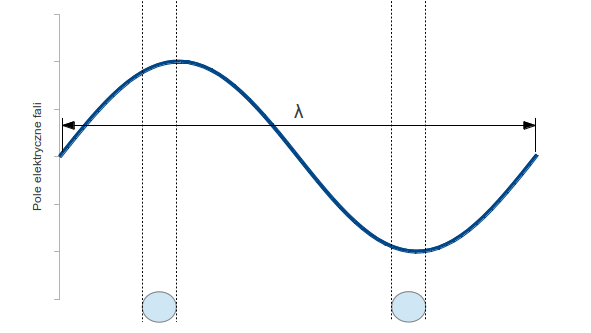
Rozpraszanie światła polega na tym, że padająca fala pobudza do drgań elektrony w cząsteczkach powietrza. Drganiom cząstek naładowanych towarzyszy zawsze powstawanie fali elektromagnetycznej (elektrony drgają w antenie i obwodach naszego telefonu komórkowego, gdy pracuje). Fala ta rozchodzi się we wszystkich kierunkach: w rezultacie część energii fali padającej jest rozpraszana na boki. Gdyby takiego rozproszenia nie było, widzielibyśmy oślepiające słońce na tle czarnego nieba. Dlaczego rozpraszanie zależy od barwy? Barwy światła związane są z długością fali. Fiolet i błękit mają najmniejszą długość fali, pomarańczowy i czerwień – największą. Wyobraźmy sobie falę elektromagnetyczną biegnącą w ośrodku, którego cząstki są znacznie mniejsze niż długość fali. Sytuację przedstawia rysunek: mamy tu falę świetlną wysłaną przez słońce przedstawioną w różnych punktach przestrzeni w jakiejś jednej chwili.
Dwie „cząsteczki powietrza” są mniejsze niż długość fali. Oznacza to, że w każdej z nich pole elektryczne padającej fali jest praktycznie jednakowe. Wobec tego elektrony w naszych „cząsteczkach powietrza” będą drgać zgodnie – a więc wytwarzane przez nie fale będą się dodawać. Gdybyśmy obserwowali falę wytworzoną przez jedną „cząsteczkę powietrza” w pewnej odległości r od tej cząsteczki, to amplituda fali wytworzonej powinna być proporcjonalna do amplitudy fali padającej: dwa razy większa fala wywoła dwa razy większe drgania elektronów. Powinna także maleć odwrotnie proporcjonalnie do r (wszystkie fale w trójwymiarowej przestrzeni tak się zachowują). Amplituda ta powinna też być proporcjonalna do objętości V naszej cząstki powietrza: bo przy dwa razy większej objętości, będzie tam dwa razy więcej elektronów. Mamy jeszcze trzecią wielkość o wymiarze odległości: długość fali λ. Ponieważ stosunek obu amplitud musi być bezwymiarowy, więc jedyną możliwą kombinacją tych wielkości jest
Natężenie fali, czyli np. przenoszona przez nią energia, jest proporcjonalne do kwadratu amplitudy, zatem natężenia będą odwrotnie proporcjonalne do czwartej potęgi długości fali – jest to bardzo silna zależność i to właśnie widzimy na niebie. Na wykresie widzimy zależność natężenia światła słonecznego od długości fali (krzywa niebieska) i tę samą zależność przefiltrowaną przez rozpraszanie Rayleigha (krzywa czerwona, jednostki na skali pionowej nie mają znaczenia, długości fal są w nm).
Widzimy, że światło o krótkich falach (niebieskie) jest rozpraszane znacznie silniej. Wrażenie barwne zależy jeszcze od wrażliwości oka na różne barwy i mechanizmu samego widzenia barwnego. Na siatkówce mamy trzy rodzaje pręcików wrażliwych na trzy różne obszary widma. To, co widzimy, jest wynikiem współdziałania tych trzech rodzajów pręcików. Nasze oczy nie są dobrym spektrometrem, ponieważ różne rozkłady natężeń mogą prowadzić do tego samego wrażenia – a więc koloru, jaki widzimy. Doświadczenia takie prowadził zresztą lord Rayleigh, który pokazał, że ustalona proporcja światła czerwonego i zielonego daje to samo wrażenie co światło żółte. W przypadku nieba wrażenie barwne jest takie samo, jak dla mieszanki monochromatycznego błękitu o długości fali 475 nm z bielą widmową.
Okazało się zresztą, że z dwóch krzywych na wykresie trudniej zrozumieć tę niebieską, czyli widmo słoneczne – jest to bowiem promieniowanie termiczne, zależne jedynie od temperatury. Zgodnie z fizyką klasyczną każdy rodzaj drgań pola elektromagnetycznego powinien mieć taką samą energię proporcjonalną do temperatury (). A ponieważ im krótsza fala, tym więcej rodzajów drgań, więc promieniowanie termiczne powinno „wybuchać” dla krótkich długości fali, co jest jawnym nonsensem. Trudność tę zauważył lord Rayleigh w roku 1900 i próbował zaproponować jakieś rozwiązanie ad hoc. Prawidłowym rozwiązaniem był wzór Plancka, i szerzej cała fizyka kwantowa.
Dodatek dla wymagających
Trochę inne uzasadnienie zależności wygląda następująco: elektrony w ośrodku w każdej chwili znajdują się w chwilowym położeniu równowagi, tzn. ich wychylenie z położenia równowagi jest w każdej chwili proporcjonalne do chwilowej wartości pola elektrycznego E (przybliżenie adiabatyczne: drgania elektromagnetyczne są stosunkowo powolne). Amplituda emitowanej fali jest proporcjonalna do przyspieszenia elektronu, zatem w ruchu harmonicznym o częstości kołowej
jest proporcjonalna do
. Natężenie zaś jest kwadratem amplitudy.
Lord Rayleigh nie ograniczył się oczywiście do argumentu wymiarowego, lecz w roku 1899 podał niezwykle elegancki wzór na współczynnik tłumienia światła (na odległości
natężenie maleje
razy), gdy mamy N cząsteczek chaotycznie rozmieszczonych w jednostce objętości:
gdzie n jest współczynnikiem załamania gazu. Wzór ten można wyprowadzić nawet w teorii sprężystego eteru. Wynika on także z rozważań w Wykładach Feynmana (t. I cz. II, równania 31.19 oraz 32.19). Wynik jest zbyt prosty, aby zależał od konkretnego modelu (choć Feynman woli raczej trzymać się konkretu). Rzeczywiście, można go uzyskać w sposób fenomenologiczny, co robią różne podręczniki elektrodynamiki. Interesujący współczynnik z trzecią potęgą bierze się częściowo z sumowania natężenia po kącie bryłowym, a częściowo z przeliczania drogi optycznej na fazę, w którym każde
odpowiada zmianie fazy o
.